Yacimientos de Gas:Parametros a seguir para el cálculo de los volumenes en los yacimientos de gas. Parte I
Tema:Parámetros a seguir para el cálculo de volúmenes en los yacimientos de gas Parte I
A)Pesos atómicos y moleculares
Esta parte ya se explico anteriormente, pero para este caso, lo importante es notar que las medidas utilizadas en la industria para la medición de estos parámetros es el mol-libra ya que utilizamos el sistema de unidades inglesa.
Por otra parte, notamos que para los ingenieros de petróleo los elementos más importantes y utilizados son: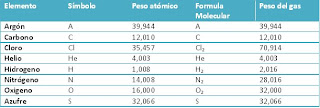
B)El mol o Mol-libra
El mol de un compuesto cualquiera es el numero de unidades de peso igual a su peso molecular, por ejemplo, un mol de metano es igual a 16,04 unidades de peso de metano:si las unidades se expresan en libras, 16,04 Lb de metano serán un mol-Lb de metano; si las unidades se expresan en gramos,16,04 g de metano sran un mol-gramo de metano.
Por lo tanto las unidades de peso molecular para la industria son: libras por mol-libras, gramos por mol- gramos o toneladas por mol-tonelada.
Experimentalmente se ha determinado que un mol de gas ideal a una presión de 14,7 lpca y una temperatura de 600 F ocupa un volumen de 379.4 p3. Estas condiciones de temperatura y presión se denominan condiciones standart o normales. No existen condiciones estándar universales; por consiguiente, en cálculos o contratos es importante especificar las mismas.
C)Ley de los gases perfectos
Este tema ya se abordo en la antigua publicación que abordaba el tema de gas como sustancia, propiedades y características, sin embargo es necesario repasar el siguiente concepto desde el punto de vista de yacimiento.
En términos generales, tres cantidades definen el estado de un gas: temperatura, presión y volumen.
Para el cálculo de volúmenes y otras propiedades, Boyle y Charles experimentaron con estas variables y encontraron la siguiente relación para una cantidad dada de gas:
El eta ecuación V1 y V2 pueden expresarse en cualquier sistema de unidades siempre y cuando sea el mismo; P1 y P2, pueden expresarse en cualquier sistema de unidades, siempre y cuando sea el mismo y sea presiones absolutas. Finalmente, T1 y T2 también pueden expresarse en cualquier sistema de unidades, siempre y cuando este sea el mismo y sea temperaturas absolutas.
Por otra parte, a través de estudios posteriores se dedujo la ecuación principal que rige el comportamiento de los gases perfectos, partiendo del enunciado en el cual n moles de gas a 600 F y 14,7lpc ocupan 379,4xn pies cubico.
Sustituyendo estos valores en la ecuación anterior tenemos:
Donde la constante 10,732 se denomina constante del gas R, y permite expresar la ecuación general de los gases perfectos:
El valor de R depende de las unidades de P, V, y T. Cuando R=10,732, P debe estar en libras por pulgada cuadrada absolutas, V en pies cúbicos; y T, en grados Rankine.
Con base a lo anterior, se tiene que una cantidad de un gas puro puede expresarse como el numero de pies cúbicos estándar (PCS) a determinada presión y temperatura, numero de moles, libras o moléculas.
Peso o Gravedad especifica del gas
Gravedad específica se define como la razón de la densidad de un gas a determinada presión y temperatura a la densidad del aire a la misma presión y temperatura, generalmente 600 F y presión atmosférica.
En la industria y en cualquier situación es más práctico medir la gravedad especifica que la densidad del gas, razón por la cual en michos cálculos se emplea preferiblemente la gravedad especifica del gas.
Otra de las razones por las cuales se emplea la gravedad especifica en mayor medida que la densidad del gas es porque esta no varia con respecto a la presión y temperatura mientras que la densidad si ya que se ve afectada principalmente por estos dos factores, así que la gravedad especifica es independiente de estos factores siempre y cuando el gas siga la ley de los gases perfectos.
La ecuación de la gravedad específica de un gas es:
GE= Densidad del gas/densidad del aire=M/28,97
Donde:
M=Peso molecular del gas (Lb-mol)
28,97=Peso molecular del aire (Lb-mol)


